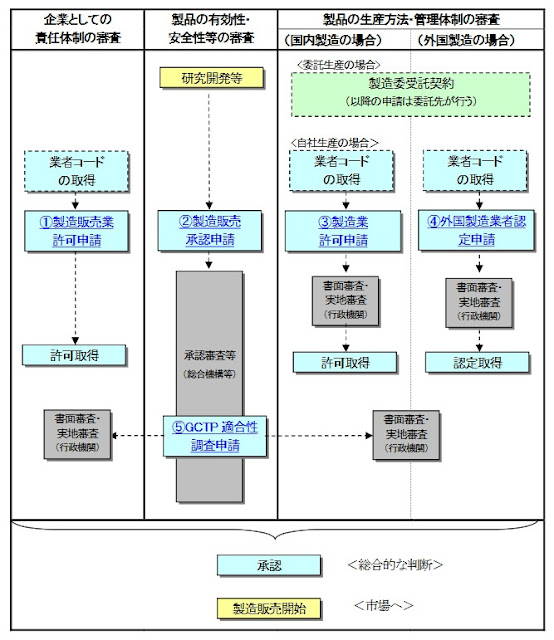
日本再生醫療相關法規 - 卡塔赫納生物安全議定書相關法律(カルタヘナ法)

日本發展再生醫學臨床研究的時候會遇到的兩大日本特有法規上的障礙,一個是別篇文章有提到的 生物由来原料基準 ,另外一個就是卡塔赫納法(カルタヘナ法),簡單來說就是為了保護生物多樣性,所以要對基改生物有所限制,防止基改生物在環境中擴散的法律。 其立法的原因是來自於日本簽訂了1993年生效的聯合國生物性多樣性公約下面,1999年於哥倫比亞的卡塔赫納議定的生物安全議定書(Cartagena protocol 全文 ),各簽約國皆需要針對公約,配合本國情況自行立法執行相關管制,現在有173個國家簽訂,而日本的詳細法條如下: 平成十五年法律第九十七号 - 遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律 然而實際操作起來卻很複雜,因為其管制單位依據用途不同會由不同的政府機關負責,大概像下面這樣: 研究開發等學術用途 - 文部科學省 酒類製造 - 財務省 醫藥品等 - 厚生勞動省 農林水產 - 農林水產省 礦工業 - 經濟產業省 然後還有分 第一種用途 - 於環境中使用,如基改作物或分解污染的藻類等 ( 手續 ) 第二種用途 - 於研究室中使用不應擴散到自然環境 ( 手續 ) 基本上就是要判斷你使用的這個東西會不會被這個法管,如果被管需要填寫那些資料備案,或是根本不能用,要經過非常長的一段戰鬥...然後臨床實驗就會被很長時間拖延,而談到輸出跟輸入又是另外一個問題了... 輸出輸入等 手續 更相關的資料可以直接看J-BCH(Japan Biosafety Clearing House)的網站有 英文版 。 參考資料: カルタヘナ法 の概 要