日本PMDA再生醫療相關產品規定
日本醫藥品醫療機器總合機構PMDA(相當於美國FDA)對再生醫療相關產品有以下的定義
- 對人或動物細胞進行培養或相關的加工後的產品,且具有
- 具備將身體的構造或機能再建、修復、形成的功能
- 疾病治療或預防的目的
- 以基因治療目的導入人體細胞所使用的產品
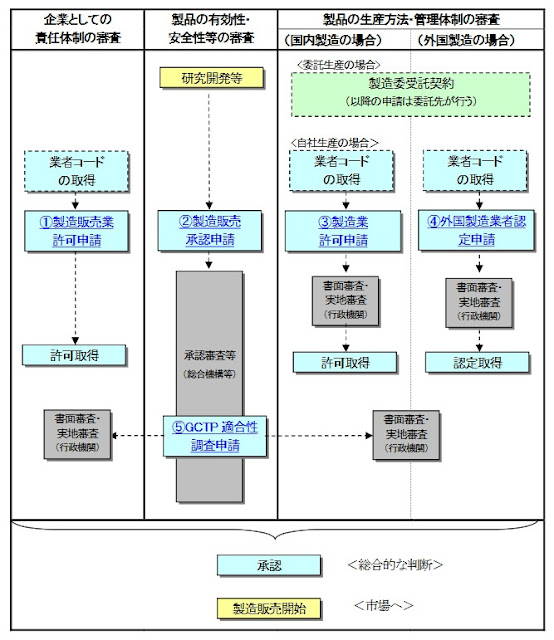
當再生醫療相關產品要面向市面販售時,需要接受有關當局以下的審查
- 企業是否具有完善的品管等責任體制 (需登錄為製造販賣業者)
- 製品有效性與安全性的審查 (需填寫產品製造販賣申請表(外國製造產品用)並經過GCTP(Good gene, Cell & Tissue Pracece)適格性調查)
- 製品生產方法與管理體制的審查 (外國產品需要申請外國製造業者認定)
關於產品開發的部分,日本政府也有給出品質管理、非臨床試驗與臨床試驗的相關準則
品管的部分需要對以下幾點有詳細記載
- 是否符合"生物由來原料基準"(可以參考另一篇文章→這裡)
- 病毒清除確效試驗(Viral clearance studies)
- 製造方法的概略流程圖
- 製造工程中的品管試驗一覽表
- 產品規格及試驗方法一覽表(如細胞純度、因子分泌狀況等)
- 經過加工的細胞的特性解析結果一覽表 (如細胞數、生存率、形態學等)
- 針對殘留於最終製品的不純物的安全評價(如牛胎兒血清蛋白或抗生素等)
非臨床安全性的部分則需要有
- 單次投毒試驗
- 反覆投毒試驗
- 核型(Karyotyping)分析試驗
各種再生醫療產品的評價指標
|
疾病與治療方法 |
評價指標詳細內容 |
| 治療人亜急性期脊髄損傷(外傷性)的iPS細胞加工製品 | 令和3年2月26日 薬生機審発0226第1号 |
| 人表皮(皮膚)再生 | 平成30年7月25日 薬生機審発0725第1号 |
| 進行関節軟骨再生的人軟骨細胞、體性幹細胞或iPS細胞加工製品 | 平成28年6月30日 薬生機審発0630第1号 |
鼻軟骨再生 |
|
|
人iPS細胞由来網膜色素上皮細胞 |
|
|
自我iPS 細胞由来網膜色素上皮細胞 |
|
|
歯周組織治療用細胞sheet |
|
|
関節軟骨再生 |
|
|
角膜内皮細胞sheet |
|
|
重症心不全細胞治療用細胞sheet |
參考資料:PMDA再生医療等製品




留言
張貼留言